2022年7月についにオープンソース化したAlphafoldが再注目
パロアルトインサイトの石角です。ある分野の専門家たちが長年悩まされていた問題が、AIを使うことで魔法のように解決してしまうことがあります。AIに関わる者として、そんな事例を見ると心が躍るものです。DeepMindが開発した「AlphaFold」は、まさにそんな例であり、生物学における研究に大きなインパクトを与えています。

シリコンバレーから現役データサイエンティストのインサイトをお届けする「The Insight」。今回取り上げるのは、タンパク質の構造を高精度で推測するAIです。
AlphaFoldはGoogleの関連会社であるDeepMindが開発したAIです。その概要を紹介します。
AlphaFoldはタンパク質の構造を高精度で予測するために開発されました。なお名称に用いられている「Fold」は「折り畳み」という意味で、アミノ酸の配列が折り畳まれたタンパク質の構造を指しています。
AlphaFoldのコードはオープンソース化され、GitHubで公開されています。また、その成果を公開するためのデータベースが構築されており、予測されたタンパク質の構造を閲覧可能です。下図はAlphaFoldが予測したタンパク質の構造の例です。
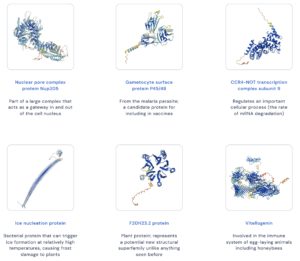
このようにタンパク質の形状は多種多様で、非常に大規模で複雑なものもあります。
私たちの体の中には膨大な種類と数のタンパク質があり、それぞれの種類に応じた働きをしています。生物の体のあらゆる仕組みを支えていることから、タンパク質は「生命の構成要素」とも言えるものです。
病気への対処や新薬の開発を進めるためには、病気の原因となるタンパク質の理解が欠かせません。しかし、多くのタンパク質の構造は未知のままであったため、開発の大きな障害となってきました。AlphaFoldによってタンパク質の構造が明らかにされることで、病気への対処や新薬の開発が一気に進むと期待されています。
AlphaFoldがオープンソース化されたのは2021年7月であり、その当時は100万程度のタンパク質の構造を予測したに過ぎませんでした。
ところがDeepMindによる2022年7月の発表によれば、AlphaFoldによる構造予測は、1年前の200倍以上となる2億以上にまで急激に対象を広げました。これはアミノ酸配列が特定されているタンパク質のほぼすべてにあたり、生物学における理解を劇的に加速させる可能性を秘めています。
2022年7月の発表では、AlphaFoldは人体のみにとどまらず、以下の分野で大きな成果を残していることが強調されました。
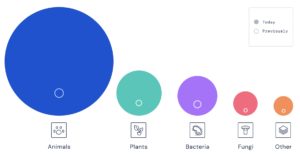
AlphaFoldが爆発的に構造予測の対象を広げたことを示したのが下図です。これにより環境破壊や食料危機などの分野でも、AlphaFoldによるタンパク質の構造予測が、研究を進める力になるでしょう。
タンパク質の構造を特定することは、「タンパク質の折り畳み問題(protein-folding probrem)」と呼ばれ、生物学における長年の課題でした。詳しく解説します。
タンパク質は、20種類のアミノ酸が決まった順序で並ぶことで構成されています。このアミノ酸の配列自体は、以前から解明が進められてきました。
しかし問題は、アミノ酸が3次元的に多くの箇所で折れ曲がって畳み込まれ、非常に複雑な形になることです。タンパク質がどのような形状をしているのか、その多くは謎のままだったのです。
1972年、ノーベル化学賞を受賞したアンフィンセン博士は、その受賞スピーチで有名な仮説を唱えました。それは
「アミノ酸の配列だけからタンパク質の形状を特定することは可能であるはずだ」
というものです。
その仮説は理論的には正しいとしても、実現は難しいものでした。アミノ酸配列から物理的な相互作用を計算したとしても、ありえる形状は無数にあり、1つには特定できなかったためです。自然界では、ごく自然なこととしてアミノ酸配列が畳み込まれ、毎回同じ形状のタンパク質が出来上がります。しかし従来の科学では、その構造の予測ができなかったのです。
なぜタンパク質の構造を知ることが重要かというと、効果的な薬や酵素などを開発するために欠かせないからです。
たとえば、アミノ酸の配列だけから考えて、ターゲットとなるタンパク質と反応する薬を開発したとします。ところが実験してみると、タンパク質の形状のせいで意図した化学反応が起こらず、薬が期待した効果を発揮しないことが多くあるのです。
これに対応するには、数え切れないほど多くの候補を用意したうえで、どれが効果があるかを1つずつ試さなければいけません。実行には多くの資金と時間が必要となります。
あるいは、あらかじめ薬のターゲットとなるタンパク質の構造を特定しておいて、それから薬を開発するという方法もあります。しかし、それも簡単なことではないのです。
これまでタンパク質の構造は、大掛かりな実験によって特定されてきました。具体的には、以下のような方法があります。
これらの方法を用いれば、たしかにタンパク質の構造を特定することは可能です。しかし、いずれの方法も、気軽に行えるものではないことが課題でした。実験を行うためには、多くの資金と長い期間が必要なのです。
つまり、ターゲットとなるタンパク質の構造を「不明なままにする」にせよ「特定する」にせよ、薬の開発には多大なコストが避けられませんでした。そのためコストに見合わない薬の開発は、本格的に始められることすらないまま、放置されてきたのです。
AlphaFoldを使うことで、実験を行うことなく、タンパク質の構造を高精度で予測できるようになりました。AlphaFoldの技術的な手法を解説します。
AIの活用提案から、ビジネスモデルの構築、AI開発と導入まで一貫した支援を日本企業へ提供する、石角友愛氏(CEO)が2017年に創業したシリコンバレー発のAI企業。
社名 :パロアルトインサイトLLC
設立 :2017年
所在 :米国カリフォルニア州 (シリコンバレー)
メンバー数:17名(2021年9月現在)
パロアルトインサイトHP:www.paloaltoinsight.com
お問い合わせ、ご質問などはこちらまで:info@paloaltoinsight.com

2010年にハーバードビジネススクールでMBAを取得したのち、シリコンバレーのグーグル本社で多数のAI関連プロジェクトをシニアストラテジストとしてリード。その後HRテック・流通系AIベンチャーを経てパロアルトインサイトをシリコンバレーで起業。東急ホテルズ&リゾーツのDXアドバイザーとして中長期DX戦略への助言を行うなど、多くの日本企業に対して最新のDX戦略提案からAI開発まで一貫したAI・DX支援を提供する。2024年より一般社団法人人工知能学会理事及び東京都AI戦略会議 専門家委員メンバーに就任。
AI人材育成のためのコンテンツ開発なども手掛け、順天堂大学大学院医学研究科データサイエンス学科客員教授(AI企業戦略)及び東京大学工学部アドバイザリー・ボードをはじめとして、京都府アート&テクノロジー・ヴィレッジ事業クリエイターを務めるなど幅広く活動している。
毎日新聞、日経xTREND、ITmediaなど大手メディアでの連載を持ち、 DXの重要性を伝える毎週配信ポッドキャスト「Level 5」のMCや、NHKラジオ第1「マイあさ!」内「マイ!Biz」コーナーにレギュラー出演中。「報道ステーション」「NHKクローズアップ現代+」などTV出演も多数。
著書に『AI時代を生き抜くということ ChatGPTとリスキリング』(日経BP)『いまこそ知りたいDX戦略』『いまこそ知りたいAIビジネス』(ディスカヴァー・トゥエンティワン)、『経験ゼロから始めるAI時代の新キャリアデザイン』(KADOKAWA)、『才能の見つけ方 天才の育て方』(文藝春秋)など多数。
実践型教育AIプログラム「AIと私」:https://www.aitowatashi.com/
お問い合わせ、ご質問などはこちらまで:info@paloaltoinsight.com
 |
 |
※石角友愛の著書一覧
毎週水曜日、アメリカの最新AI情報が満載の
ニュースレターを無料でお届け!
その他講演情報やAI導入事例紹介、
ニュースレター登録者対象の
無料オンラインセミナーのご案内などを送ります。